北京怀柔医院关于研究者发起的临床研究管理流程的通知
根据《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》要求,为规范管理我院研究者发起的临床研究,特制订本流程。请各科室、部门按照管理流程要求开展临床研究。
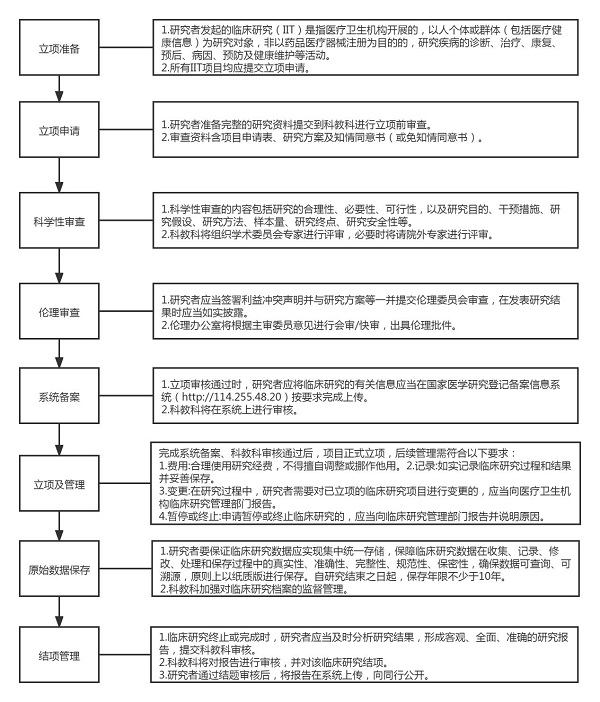
一、管理流程
1、研究发起人提出临床研究申请
研究发起人拟定研究方案,填写《研究者发起的临床研究立项申请表》(见附件1、2),科室审核通过后提交至科教科。
2、科学性审查
科教科对研究小组成员资质、研究方案及附件等进行形式审查,组织专家(副高及以上)3人及以上论证其必要性、创新性、科学性、可行性、安全性等。
3、伦理审查
通过科学性审查并涉及人的研究项目,研究发起人须提交伦理审查相关文件至伦理委员会,获得伦理审查批件。
4、系统备案
在我院通过通过科学性审查及伦理审查的临床研究项目,应在国家医学研究登记备案信息系统(http://114.255.48.20)按要求完成上传。
5、科教科立项
通过科学性审查及伦理审查,同时并完成系统备案的临床研究项目,科教科下达立项通知。
6、项目实施
(1)研究发起人严格遵照《药物临床试验质量管理规范》、伦理批准的研究方案实施临床研究。
(2)在研究过程中,若发生不良事件,研究发起人按照《不良事件和严重不良事件处理SOP》立即处理,并及时报送伦理委员会及上级卫生行政管理部门。
7、质量管理
(1)研究发起人对本研究涉及的伦理以及受试者的安全、数据的真实性等负责。
(2)科教科根据项目情况检查研究项目的质量和进度,对存在的问题提出书面整改意见,研究发起人应予以整改并给予书面答复。
8、总结报告
研究结束后,研究发起人撰写“总结报告”,科主任审核签字后报告至科教科。科教科邀请3名同行专家评议(副高及以上)。
二、流程图
三、文件解读
现将《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》原文及文件解读(见附件3)一并下发,请各科室认真学习落实。本通知自公布之日起执行,科教科负责解释。
联系人:刘白羽,联系电话:8093
![]() 附件3:医疗卫生机构开展研究者发起的临床研究管理办法(试行).docx
附件3:医疗卫生机构开展研究者发起的临床研究管理办法(试行).docx
科教科
2021.12.10










